传奇CAR-T为何成功?信达PD-1为何被拒?
当地时间2月28日,FDA正式批准传奇生物/强生的BCMA CAR-T疗法Ciltacabtagene autoleucel(cilta-cel,西达基奥仑赛,商品名为Carvykti)上市,该药成为中国首个获FDA批准的细胞治疗产品,以及全球第二款靶向BCMA的CAR-T细胞免疫疗法。西达基奥仑赛的获批也见证了中国创新药出海的一个重要“里程碑”。
传奇生物凭什么“乘风破浪”?
在信达生物PD-1在FDA的审批受阻的背景下,传奇生物的西达基奥仑赛能否“出海”引起大家更多的关注。
据了解,西达基奥仑赛是传奇生物自主研发的一款BCMA靶向CAR-T,该疗法含有4-1BB共刺激结构域和两个BCMA靶向单域抗体,旨在增加其靶向癌细胞的综合能力,用于成人复发/难治性多发性骨髓瘤(MM)的治疗。
据悉,西达基奥仑赛递交上市申请(BLA)主要是基于关键性Ⅰb/Ⅱ期CARTITUDE-1研究的结果,该研究评估了西达基奥仑赛在复发和/或难治性多发性骨髓瘤患者中的有效性和安全性。招募的97例受试者中,99%接受末线治疗无效,其中88%既往接受过至少3线治疗。
研究结果显示,中位随访12.4个月时,独立委员审查的ORR为97%,包括67%的sCR(严格的完全缓解),26% 的VGPR(非常好的部分缓解)和4%的PR。≥3级细胞因子综合征(CRS)发生率为5%,≥3级神经毒性发生率为10%。
在业内人士看来,以信达生物PD-1被FDA拒绝(→点击回顾)核心原因来审视传奇生物的西达基奥仑赛,几乎很难挑出大毛病。首先,传奇生物西达基奥仑赛向FDA递交上市的申请基础为全球多中心临床试验数据,涉及美国、日本、欧盟等地区的临床研究数据,相较于信达生物单一的中国临床数据更加具有说服力;第二,传奇生物主要终点设置为ORR,与已获批的Abecma设置标准对应,相比之下,信达生物的信迪利单抗的对照组不符合美国临床实践标准;第三,PD-1/L1产品在美国已经上市多款,且信迪利单抗申报的非小细胞肺癌适应症,临床治疗方案选择较为丰富,需求基本得到满足,而美国仅有一款BCMA CAR-T疗法。因此对于西达基奥仑赛成功获FDA批准上市,业内存在乐观预期。
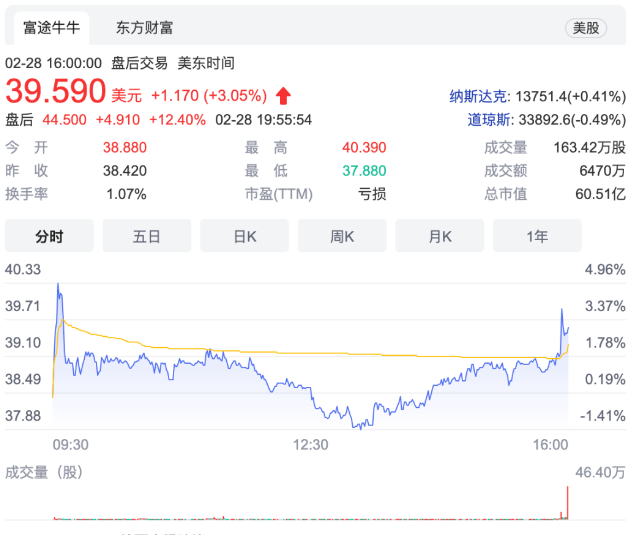
在信达生物PD-1出海受阻的背景下,西达基奥仑赛成功登陆美国市场,也为国内医药从业者和投资人带来巨大信心。受此消息影响,传奇生物股价盘后大涨12%,截至收盘报39.59美元,市值达到68亿美元。
据相关数据统计,截至目前有16款中国新药力求进入美国市场,其中8款上市申请获得FDA的受理。除信达生物、百济神州、君实生物、康方生物4款PD-1以及外传奇生物在内的细胞疗法西达基奥仑赛外,还有和黄医药的索凡替尼、亿帆医药的F-627、腾盛博药新冠中和抗体安巴韦单抗/罗米司韦单抗联合疗法等创新药,其探索都值得尊敬,无论结果如何,都将为本土医药产业迈向高质量发展阶段积累宝贵经验。
中美细胞治疗赛道“龙争虎战”
作为目前最具创新性的基因疗法之一,CAR-T细胞免疫疗法近年来一直备受业界关注。该疗法主要用于治疗血液癌症,将患者的T细胞提取并修饰为CAR-T细胞,以精确地攻击癌细胞。随着CAR-T热度上升,越来越多的企业开始进入赛道,无论是跨国药企还是本土药企,围绕这一领域的研发热情只增不减。
截至2021年4月16日,全球共有2073种活性细胞治疗药物研发管线,比2020年同期增加了572种,增长率为38%。在不同类型的细胞治疗中,CAR-T继续占据主导地位,增加了299种CAR-T新药物,比2020年同期增加了35%。大多数CAR-T疗法(80%)处于临床前和临床Ⅰ期阶段。此外,TCR-T细胞疗法增加了80种新药,其次是NK/NK-T细胞疗法,增加了67种。
据统计,2020年国内已有355个正在进行的CAR-T临床试验,复星凯特的Yescarta成为中国首款CAR-T细胞治疗产品。在适应症的选择上,我国项目主要以血液瘤适应症为主,靶点主要集中于CD19和BCMA;实体瘤靶点主要包括GPC3和Claudin18.2。
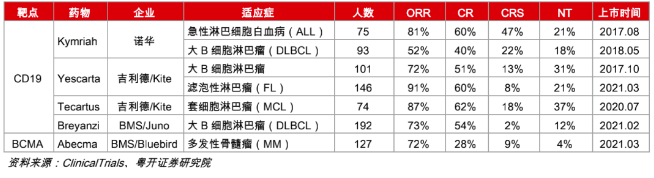
截至目前,加上传奇生物的西达基奥仑赛,美国FDA已批准上市6款CAR-T细胞疗法。分别是:诺华的Kymriah,Kite的Yescarta、Tecartus,Juno的Breyanzi,以及百时美施贵宝(BMS)和Bluebird Bio的Abecma。
FDA此前批准上市的CAR-T疗法
国内也已有两款CAR-T疗法上市:一是2021年国家医保药品目录调整通过初步形式审查申报、但最终未进入谈判的阿基仑赛注射液,另一个是国内第二款获批上市、国内首款1类生物制品瑞基仑赛注射液。
除了要面对竞争日益激烈的赛道,CAR-T研发者还要考虑定价问题。西达基奥仑赛作为全球第二款获批上市的靶向BCMA的CAR-T疗法,其上市之后最直接的竞争对手是BMS的Abecma,据了解,传奇生物的BCMA CAR-T定价为46.5万美元;BMS的BCMA CAR-T定价为41.95万美元。
先发就是优势,最早上市的Kymriah在2021年销售额达到5.87亿美元,同比增长24%;第二个获批上市的Yescarta,2021年的销售额为6.9亿美元,同比增加23%;而2021年刚上市的Breyanzi和Abecma上半年销售收入仅分别达到0.87亿美元和1.7亿美元。
值得注意的是,西达基奥仑赛是传奇生物即将商业化的第一款产品。在2月18日传奇生物公告的业绩中,公司销售和营销费用约为9530万~1.062亿美元,这主要是由于西达基奥仑赛的商业准备活动相关的成本增加。这意味着传奇生物已做好西达基奥仑赛的销售准备,但其能否不负众望,做好首款产品的商业化,都要留给时间作答。
创新风险高 竞争“四郊多垒”
虽然传奇生物凭借西达基奥仑赛在美国上市申请获FDA批准,实现国产细胞治疗药物“零的突破”,但创新本身蕴含着较大的风险,一方面是品种研发和审批存在不确定性;另一方面是竞争加剧,在当前的CAR-T研发热潮中,大量药企在布局,几年后竞争会非常激烈。
2月15日,金斯瑞发布公告称,子公司传奇生物在11日收到美国FDA的邮件通知,暂停了旗下一款CAR-T产品的Ⅰ期临床试验。该产品是一款针对恶性CD4+T细胞的CAR-T疗法,将用来治疗复发或难治性T细胞淋巴瘤的成人患者。这是传奇生物第二款出海的CAR-T产品。
据了解,除了西达基奥仑赛外,传奇生物研发进展最快的一款产品就是LB1901,目前在国内和美国均已推进至临床Ⅰ期阶段。这是一款CD4的CAR-T产品,目前全球范围内的主要竞争对手是美国基因治疗公司iCell。早在2020年12月,传奇生物便已经拿到了FDA授权开展有关LB1901新药临床的批文,但直到2021年9月,这项Ⅰ期临床才正式启动。
公告显示,截至目前已经有一名患者在该项临床试验中接受了注射,但出现了外周血CD4+ T细胞计数低的情况,传奇生物依照试验方案已经暂停了该临床试验并通知了FDA。该名患者未发生药物相关严重不良事件(SAEs),目前正在按照试验方案进行监测。
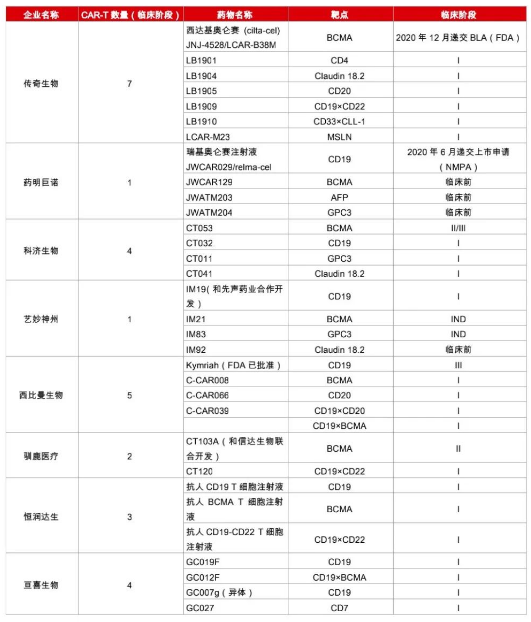
众所周知,新药研发是一场九死一生的冒险,在早期临床阶段出现问题更是常事。但CAR-T赛道上依然拥挤,目前国内布局CAR-T细胞疗法的公司或者机构非常多,其中布局产品数量靠前的有传奇生物、西比曼生物、科济药业、亘喜生物等。
国内企业CAR-T疗法布局
值得注意的是,在治疗领域上,CAR-T疗法的适应症集中在血液肿瘤(主要为白血病、淋巴瘤与骨髓瘤等),但血液肿瘤在全部人体恶性肿瘤中只占约10%,其余90%都是实体瘤,比如肺癌、肝癌、乳腺癌等。若CAR-T能在实体瘤方面有所突破,其商业价值会进一步提升。因此,不少公司致力于差异化布局,比如深耕实体瘤领域。
除了常规的CAR-T疗法,TCR-T疗法因在实体瘤治疗领域具备独特优势,已成为研发热点。据不完全统计,目前国内外处于临床以上阶段的药物有53个,大部分处于Ⅰ/Ⅱ期和临床前的早期阶段,适应症包括转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤、宫颈癌等。
Immunocore公司日前宣布,美国FDA已批准其创新疗法Kimmtrak上市,这是FDA批准的首款治疗不可切除或转移性葡萄膜黑色素瘤的疗法,也是首款获得监管部门批准的T细胞受体(TCR)疗法。
作为拥有首个上市CAR-T细胞疗法的公司,诺华在TCR-T细胞疗法上的投入也不少。除了多轮投资TScan外,诺华还与TScan在2020年4月达成了数亿美元的合作,以开发多达靶向3个新靶点的TCR-T细胞疗法。
国内企业如香雪精准,则以细胞免疫治疗为切入点,致力于研发具有我国自主知识产权的针对肿瘤的特异性T细胞过继免疫治疗的新方法。当前已建立了从TCR-T 产品研发、制备、质控、产品产业化到临床转化的全覆盖的研发平台,有覆盖绝大部分群体基因型的产品管线。其开发的抗原特异性高亲和性T细胞受体转导的自体T细胞疗法(TAEST),第一款产品TAEST16001注射液已获得国家药监局批准进入新药临床试验,是中国首个进入注册制临床试验的TCR-T细胞药品。
总的来看,CAR-T赛道已是非常拥挤,未来市场竞争也会更加激烈,未来商业化能力对很多公司是一种考验。
【版权声明】秉承互联网开放、包容的精神,医药网欢迎各方(自)媒体、机构转载、引用我们原创内容,但要严格注明来源医药网;同时,我们倡导尊重与保护知识产权,如发现本站文章存在版权问题,烦请将版权疑问、授权证明、版权证明、联系方式等,发邮件至pharmnet@netsun.com,我们将第一时间核实、处理。
- 相关报道
-
- 驯鹿医疗与信达生物共同开发的BCMA CAR-T候选产品获美国FDA授予“孤儿药”认定(2022-02-14)
- 中国原研CD19 CAR-T创新药走向全球(2022-01-21)